Pressemitteilungen Archiv
12.07.2019
Kontrollierter Stoffaustausch zwischen den Zellen fädiger Cyanobakterien
Forschungsteam der ETH Zürich und der Universität Tübingen klärt hochaufgelöst die Struktur und Funktion der Zell-Zell-Verbindungen
Die meisten Bakterien sind Einzeller. Dagegen bilden manche Cyanobakterien, auch als Blaualgen bekannt, vielzellige Fäden, die bereits auf bestimmte Aufgaben spezialisierte Zellen besitzen. Sie gehören damit zu den komplexesten Lebewesen im Bakterienreich. Bisher war wenig darüber bekannt, über welche Verbindungen sich die einzelnen Zellen untereinander austauschen. Das haben Gregor Weiss und Professor Martin Pilhofer von der ETH Zürich gemeinsam mit Ann-Katrin Kieninger, Dr. Iris Maldener und Professor Karl Forchhammer vom Interfakultären Institut für Mikrobiologie und Infektionsmedizin der Universität Tübingen genauer untersucht. Mit einem speziellen Verfahren der Elektronen- und Fluoreszenzmikroskopie belegte das Team, dass die Verbindungen zwischen den Zellen aus einer Proteinröhre bestehen, die an beiden Enden mit einem Stopfen verschlossen werden kann. Damit fügen die Forscher dem Wissen über Cyanobakterien sowie der Entwicklung von Kommunikationsstrukturen bei Mehrzellern ein weiteres Puzzleteil hinzu. Die Studie wird in der Fachzeitschrift Cell veröffentlicht.
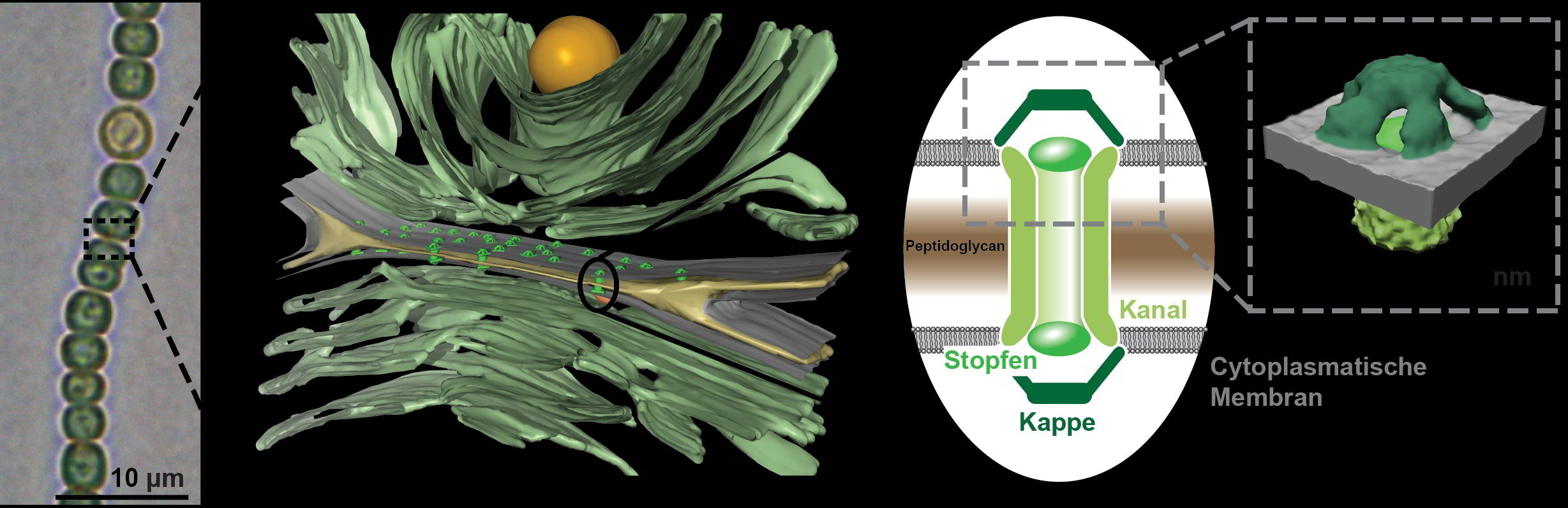
Cyanobakterien besiedelten die Erde bereits vor 2,5 Milliarden Jahren. Dank ihrer Fähigkeit zur Sauerstoff freisetzenden Fotosynthese ebneten sie höherem Leben den Weg in der Evolution. In den fädigen Cyanobakterien sind die einzelnen Zellen perlschnurartig zu Ketten verbunden. Fotosynthese treibende Zellen ernähren ihre Stickstoff fixierenden Schwesterzellen mit Zucker, in umgekehrter Richtung fließen Stickstoffverbindungen. „Für diesen regen Stofftransport haben Cyanobakterien spezielle Zellverbindungen, sogenannte Septalverbindungen, entwickelt“, erklärt Iris Maldener.
In dünne Schichten zerlegt
„Mit herkömmlicher Elektronenmikroskopie konnte man die Details dieser Zellverbindungen bisher nicht klären. Dank einer Erweiterung der KryoElektronenmikroskopie ist es uns gelungen, Einblicke in bislang unerreichter Genauigkeit zu erhalten“, sagt Martin Pilhofer. Pilhofers Doktorand Gregor Weiss entwickelte ein Verfahren, um die Cyanobakterien so zu präparieren, dass die Kanäle sichtbar gemacht werden konnten. Dazu „fräste“ Weiss in gefrorenen Cyanobakterien die Verbindungsstelle zwischen zwei Zellen schichtweise ab, bis seine Probe dünn genug war. Die kugeligen Zellen wären ohne Vorbehandlung für eine Anwendung in der Kryo-Elektronenmikroskopie zu dick. Mit dieser Methode zeigten die Forscherinnen und Forscher, dass die Proteinröhren, die die Zellinhalte benachbarter Zellen verbinden, durch Membran und Poren in den jeweiligen Zellwänden verlaufen. Jede Röhre mit einem Innendurchmesser von sieben Nanometern ist an den Enden mit fünfarmigen Proteinelementen überdacht, die ähnlich einer Kamerablende angeordnet sind. Zwischen benachbarten Zellen gibt es Dutzende solcher Verbindungskanäle.
„Aufgrund der komplexen Struktur der Verbindungskanäle vermuteten wir einen Mechanismus, der die Kanäle öffnet und schließt“, berichtet Forchhammer. Die Doktorandin Ann-Katrin Kieninger untersuchte daher den Stoffaustauch unter Stressbedingungen. Cyanobakterienketten wurden mit einem fluoreszierenden Farbstoff gefärbt und anschließend einzelne Zellen gezielt mit Hilfe eines Lasers gebleicht. Die Forscher maßen den Farbstoffeinstrom aus benachbarten Zellen. So konnten sie zeigen, dass die Kanäle bei Behandlung mit bestimmten Chemikalien oder im Dunkeln tatsächlich dicht machen.
Schutz für den gesamten Zellverband
Das Forschungsteam entdeckte, dass sich die filigrane Kappenstruktur des Kanals dabei wie eine Irisblende verschließt. Der Stoffaustausch zwischen den Zellen wird unterbrochen. „Ein solcher Schließmechanismus schützt den gesamten Zellverband“, sagt Forchhammer. So könne eine Zelle verhindern, dass sie beispielsweise Schadstoffe an ihre Nachbarzellen weitergebe. „Auch kann bei einem Angriff von Fressfeinden oder bei mechanischer Beschädigung das Auslaufen der Zellinhaltsstoffe des gesamten Zellverbundes verhindert werden.“
Die hier aus dem Bakterienreich beschriebenen Zell-Zell-Verbindungen seien die ältesten molekularen Strukturen für Vielzelligkeit, berichtet Maldener. Zellverbindungen seien in verschiedenen vielzelligen Lebewesen im Lauf der Evolution mehrmals erfunden wurden und hätten sich parallel entwickelt. „Dies unterstreicht, wie wichtig es ist, dass ein mehrzelliger Organismus den Warentransport zwischen einzelnen Zellen kontrollieren kann“, sagt Pilhofer.
Publikation:
Weiss GL, Kieninger A-K, Maldener I, Forchhammer K, Pilhofer M. Structure and function of a bacterial gap junction analog. Cell, 11. Juli 2019. https://doi.org/10.1016/j.cell.2019.05.055
Kontakt:
PD Dr. Iris Maldener
Universität Tübingen
Interfakultäres Institut für Mikrobiologie und Infektionsmedizin
+49 7071 29-78847
iris.maldener@mikrobio.uni-tuebingen.de
Prof. Dr. Martin Pilhofer
Eidgenössische Technische Hochschule Zürich
Department of Biology,
Institute of Molecular Biology & Biophysics
Pilhofer@biol.ethz.ch
Pressekontakt:
Eberhard Karls Universität Tübingen
Hochschulkommunikation
Dr. Karl Guido Rijkhoek
Leitung
Janna Eberhardt
Forschungsredakteurin
+49 7071 29-77853
Telefax +49 7071 29-5566
janna.eberhardt@uni-tuebingen.de
www.uni-tuebingen.de/universitaet/aktuelles-und-publikationen.html