News aus der Fakultät
20.01.2015
Physiker sehen Proteinkristallen beim Wachsen zu
Entstehung über einen Zwischenschritt aus einem vorläufigen Aggregat
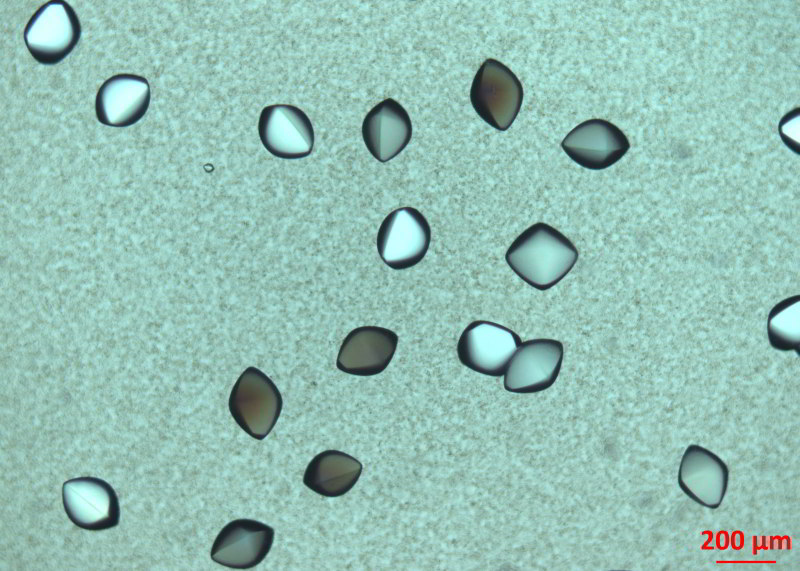
Um die Struktur von Proteinen zum Beispiel bei der Wirkstoffsuche in der Arzneimittelforschung präzise zu bestimmen, benötigen Wissenschaftler diese in Form von Kristallen. Doch das Züchten von Proteinkristallen ist keine Routineangelegenheit, sondern häufig der sprichwörtliche Flaschenhals bei den Untersuchungen. Daher haben Andrea Sauter, Fajun Zhang und Professor Frank Schreiber vom Institut für Angewandte Physik der Universität Tübingen nun in Zusammenarbeit mit Kollegen aus Oxford und Grenoble einen wichtigen Schritt in der Keimbildung und dem Wachstum von Proteinkristallen beobachtet. Anders als bei der klassischen Theorie, nach der sich von Beginn an ein Keim in der endgültigen Form des Kristalls bildet, haben die Forscher einen Zwischenschritt bei der Kristallbildung beobachtet. Sie können nun die Dynamik der Proteinkristallisation genauer beschreiben, als dies bisher möglich war. Ihre Ergebnisse veröffentlichten die Physiker in der aktuellen Ausgabe der Fachzeitschrift Journal of the American Chemical Society.
Für das Züchten eines Kristalls bringen die Forscher den reinen Stoff in eine übersättigte Lösung. Darin bilden sich Keime, an die sich wie bei einem dreidimensionalen Puzzle aus lauter gleichen Teilen immer mehr Stoffmoleküle an die vorgegebene Passform anlagern können. So wächst der Kristall schließlich zu einer Größe, die auch für das menschliche Auge sichtbar sein kann. Die Tübinger Physiker haben vor allem die erste Phase der Bildung eines Proteinkristallkeims mittels Röntgenstrahlen und optischer Mikroskopie in Echtzeit untersucht. „Zunächst lagern sich die Proteinmoleküle zu Aggregaten zusammen“, berichtet Andrea Sauter. Sie hätten jedoch noch nicht die Form des späteren Kristalls. „Je mehr des Proteins in diese Zwischenphase eintritt, desto schneller bilden sich die Keime.“
Die Wachstumsgeschwindigkeit der neuen Kristalle sei in diesem Schritt jedoch gering, was mit der geringen Mobilität der Proteine im Aggregat zusammenhängen könnte. Dieser erste Schritt dauert an, bis das Aggregat aufgebraucht ist. Danach wächst der Kristall schneller. Beweglichere Proteinmoleküle aus der gelösten, flüssigen Phase können direkt an der Wachstumsfront des Kristallkeims andocken. Zu dieser Zeit bilden sich neue Keime jedoch deutlich langsamer. „All diese Beobachtungen deuten darauf hin, dass die Proteinaggregate als Vorläufer der Kristalle eine wichtige Rolle in dem zweistufigen Prozess spielen“, fasst die Wissenschaftlerin zusammen. Möglicherweise lassen sich aus dem tieferen Verständnis der Vorgänge verbesserte Techniken für die Praxis der Kristallzüchtung und damit für wichtige Fragestellungen der Arzneimittelforschung und der Strukturbiologie ableiten.
Originalveröffentlichung:
Andrea Sauter, Felix Roosen-Runge, Fajun Zhang, Gudrun Lotze, Robert M. J. Jacobs, Frank Schreiber: Real-Time Observation of Nonclassical Protein Crystallization Kinetics. Journal of the American Chemical Society, DOI: 10.1021/ja510533x.
Kontakt:
Andrea Sauter
Universität Tübingen
Institut für Angewandte Physik
Telefon +49 7071 29-76397
<link mail ein fenster zum versenden der>andrea.sauter[at]uni-tuebingen.de
Eberhard Karls Universität Tübingen
Hochschulkommunikation
Dr. Karl Guido Rijkhoek
Leitung
Janna Eberhardt
Forschungsredakteurin
Telefon +49 7071 29-77853
Telefax +49 7071 29-5566
janna.eberhardt[at]uni-tuebingen.de
<link http: www.uni-tuebingen.de aktuelles external-link-new-window externen link in neuem>www.uni-tuebingen.de/aktuelles