Pressemitteilungen Archiv
01.02.2016
Poren in Form von Ringen und Halbmonden treiben die gestresste Zelle in den programmierten Tod
Tübinger Forscher entdecken mithilfe eines Supermikroskops, wie Bax-Proteine Hüllen durchlässig machen
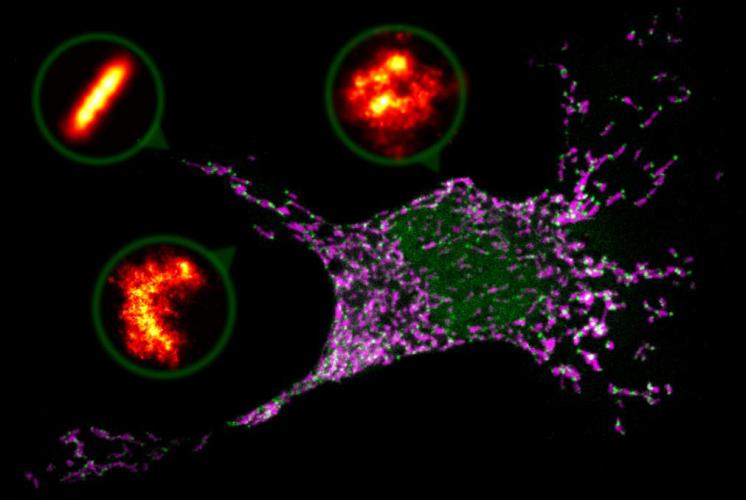
Geschädigte Zellen können über die sogenannte Apoptose, den programmierten Zelltod, selbst für ihre Auflösung sorgen. Funktioniert dieser Mechanismus nicht mehr richtig, kann die Zelle zur Krebszelle werden. Forscherinnen und Forscher unter der Leitung von Professorin Ana García-Sáez vom Interfakultären Institut für Biochemie der Universität Tübingen klären wichtige Schritte des Prozesses auf. Sie wussten aus vorherigen Studien, dass die Apoptose mit der Aktivierung von Proteinen namens Bax eingeleitet wird. Steht die Zelle unter Stress, so lagern sich Bax-Proteine in symmetrischen Zweiereinheiten zusammen. Als nächstes ließ sich beobachten, dass die sonst dichte Hülle der Mitochondrien durchlässig wird und Cytochrom c passieren lässt. Dann ist das Zelltodprogramm nicht mehr umkehrbar, die Zelle löst sich auf. Doch was zwischendrin passierte, war rätselhaft und hat Apoptoseforscher lange beschäftigt. Nun konnten Ana García-Sáez und ihre Kollegen mithilfe eines Supermikroskops sichtbar machen, wie die Bax-Proteine sich in der Mitochondrienhülle zu Poren zusammenlagern und sie so durchlässig machen. Die neue Studie wurde in The EMBO Journal veröffentlicht.
In gesunden Zellen ist Bax als lösliches Einzelprotein zu finden, das sich zwischen dem Zellplasma und der Oberfläche hin- und herbewegt. Auf Stresssignale hin werden Bax-Proteine angehäuft. Forscher hatten bereits vermutet, dass Bax-Zweiereinheiten sich zur Bildung von Poren zusammenfinden und die äußere Hülle der Mitochondrien für bestimmte Stoffe öffnen. Doch bisher war es nicht gelungen, die Bax-Zweier dabei zu beobachten oder Strukturen zu sehen, die Poren auf den Mitochondrien darstellen könnten. Daher waren schon Zweifel an diesem Szenario aufgekommen.
In Zusammenarbeit mit Jonas Ries vom EMBL in Heidelberg wählten Ana García-Sáez und ihre Arbeitsgruppe eine hochauflösende Mikroskopiemethode, mit der sich einzelne Moleküle sichtbar machen lassen. Sie erhielten Aufnahmen von Zellen unter Stress im Zelltodmodus, in denen sich Bax-Proteine sammelten. Die Bax-Strukturen, die sie fanden, waren unterschiedlich groß und unterschiedlich geformt, konnten aber nicht zufällig entstanden sein: Es gab Ringe, unvollständige Ringe, Bögen wie einen Halbmond und auch linienförmige Anordnungen. Gleichzeitig mit dieser Porenbildung wurde die Hülle der Mitochondrien durchlässig. So können die Forscher frühere Vermutungen bestätigen und eine entscheidende Wissenslücke im Ablauf der Apoptose schließen.
Publikation:
Raquel Salvador-Gallego, Markus Mund, Katia Cosentino, Jale Schneider, Joseph Unsay, Ulrich Schraermeyer, Johann Engelhardt, Jonas Ries and Ana J García-Sáez: Bax assembly into rings and arcs in apoptotic mitochondria is linked to membrane pores. The EMBO Journal, DOI 10.15252/embj.2015933841
Kontakt:
Prof. Dr. Ana García-Sáez
Universität Tübingen
Interfakultäres Institut für Biochemie
Telefon +49 7071 29-73318
<link mail window for sending>ana.garcia[at]uni-tuebingen.de
Eberhard Karls Universität Tübingen
Hochschulkommunikation
Dr. Karl Guido Rijkhoek
Leitung
Janna Eberhardt
Forschungsredakteurin
Telefon +49 7071 29-77853
Telefax +49 7071 29-5566
janna.eberhardt[at]uni-tuebingen.de
www.uni-tuebingen.de/aktuelles