Pressemitteilungen
11.04.2018
Ein Immungedächtnis im Gehirn
Entzündungsreaktionen können die Immunzellen des Gehirns langfristig verändern – die Zellen haben also ein „Immungedächtnis“. Dieses Immungedächtnis beeinflusst möglicherweise den Verlauf später auftretender neurologischer Erkrankungen und stellt somit einen bislang unbekannten Faktor dar, der den Schweregrad dieser Krankheiten beeinflussen könnte. Das berichten Wissenschaftler am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE), dem Hertie-Institut für klinische Hirnforschung (HIH) und der Universität Tübingen in der renommierten Zeitschrift „Nature“. Ihre Studie beruht auf einer Kooperation mit Forschern aus Göttingen, Bonn und Freiburg.
Mikroglia sind Immunzellen, die nur im Gehirn vorkommen. Sie schützen das Gehirn, indem sie es von Fremdkörpern oder toxischen Substanzen reinigen. In bestimmten Fällen können sie jedoch auch Schaden anrichten. Schon lange stehen sie im Verdacht, bei neurodegenerativen Erkrankungen eine zentrale Rolle zu spielen.
Da Mikroglia sehr langlebig sind, interessierten sich die Wissenschaftler für die Frage, ob sich diese Immunzellen im Laufe der Zeit durch Umwelteinflüsse verändern und welchen Einfluss dies auf die Gesundheit des Gehirns hat. „Aus epidemiologischen Studien weiß man, dass Infektionskrankheiten oder Entzündungen über die Lebensspanne hinweg den Schweregrad einer viel später auftretenden Alzheimer-Erkrankung beeinflussen können. Wir haben uns daher gefragt, ob ein Immungedächtnis in den langlebigen Mikroglia dieses Risiko vermitteln könnte“, erklärt Dr. Jonas Neher, Leiter der Studie und Wissenschaftler am DZNE und am HIH.
Stimulierte Immunreaktion
Um dieser Frage nachzugehen, lösten Neher und seine Kollegen in Mäusen eine Entzündung außerhalb des Gehirns aus; es war bereits bekannt, dass dies eine Immunreaktion im Gehirn hervorrufen kann. Ob Mikroglia sich an eine vorhergehende Entzündung erinnern könnten, war jedoch unklar. Je nachdem, wie oft die Wissenschaftler diesen Vorgang wiederholten, konnten sie in den Mikrogliazellen des Gehirns zwei verschiedene Zustände hervorrufen: „Training“ und „Toleranz“. Durch die erste entzündliche Aktivierung wurden die Mikroglia trainiert – bei der nächsten reagierten sie deshalb stärker. Nach viermaliger Aktivierung hingegen war Toleranz eingetreten und die Mikroglia sprachen kaum noch an.
In einem nächsten Schritt untersuchten die Forscher, wie sich Training und Toleranz der Mikroglia langfristig auf die Bildung von Amyloid-Plaques – charakteristische toxische Ablagerungen im Gehirn von Alzheimerpatienten – auswirken. In einem Mausmodell der Alzheimer Pathologie beobachteten Neher und seine Kollegen, dass trainierte Mikroglia auch noch viele Monate nach dem Auslösen des Immungedächtnisses zur verstärkten Bildung von Plaques führten und somit den Krankheitsverlauf verschlimmerten. Tolerante Mikroglia hingegen verringerten die Menge der Plaques. Ähnliche Unterschiede beobachteten die Wissenschaftler auch in einem Mausmodell von Schlaganfall.
Veränderungen an der DNA
Um diese Unterschiede genauer zu verstehen, untersuchten die Forscher epigenetische Veränderungen der Mikroglia – das heißt chemische Modifikationen an der DNA oder ihren Verpackungsproteinen, die dazu führen, dass bestimmte Gene dauerhaft stärker oder weniger stark aktiviert sind. Da epigenetische Modifikationen sehr beständig sind, sahen die Forscher in ihnen eine mögliche Erklärung für die langfristigen Verhaltensänderungen der Mikroglia. Diese Vermutung erwies sich als richtig: Auch viele Monate nach der ersten Immunstimulierung zeigten trainierte und tolerante Mikroglia spezifische epigenetische Veränderungen und entsprechende Unterschiede in der Genaktivierung. Diese molekulare Reprogrammierung veränderte wichtige Funktionen der Mikroglia, wie zum Beispiel das Entfernen der Amyloid Plaques und damit das Ausmaß der Alzheimer-Pathologie.
Folgen für neurodegenerative Erkrankungen?
„Es ist vorstellbar, dass auch beim Menschen entzündliche Krankheiten, die sich primär außerhalb des Gehirns entwickeln, das Immunsystem im Gehirn epigenetisch reprogrammieren“, sagt Neher. Sowohl Infektionen als auch Erkrankungen wie Diabetes oder Arthrose gehen mit Entzündungsreaktionen einher und sind bekannte Risikofaktoren für die Alzheimer Erkrankung. Das Immungedächtnis des Gehirns – epigenetisch veränderte Mikroglia – wäre hierfür eine mögliche Erklärung. Unter welchen Bedingungen sich Mikroglia beim Menschen epigenetisch verändern und welche therapeutischen Möglichkeiten sich daraus ergeben, ist nun Gegenstand weiterer Untersuchungen.
Förderhinweis
Diese Studie wurde unterstützt durch ein Promotionsstipendium der Studienstiftung des Deutschen Volkes, ein Roman-Herzog-Forschungsstipendium der Hertie-Stiftung sowie von Fördermaßnahmen aus dem Netzwerk ‘Neuroinflammation in Neurodegeneration’, der Sobek-Stiftung, der DFG, dem European Research Council, dem Fortüne-Programm, der Fritz Thyssen Stiftung und der Paul G. Allen Family Foundation.
Originalpublikation
Wendeln, Degenhardt et al. (2018): “Innate immune memory in the brain shapes neurological disease hallmarks“, Nature, Online Vorabveröffentlichung am 11.04.2018
doi: 10.1038/s41586-018-0023-4
Kontakt:
Dr. Jonas Neher
Deutsches Zentrum für Neurodegenerative Erkrankungen
Hertie-Institut für klinische Hirnforschung
Universität Tübingen
Telefon +49 7071 925-4351
 |  |
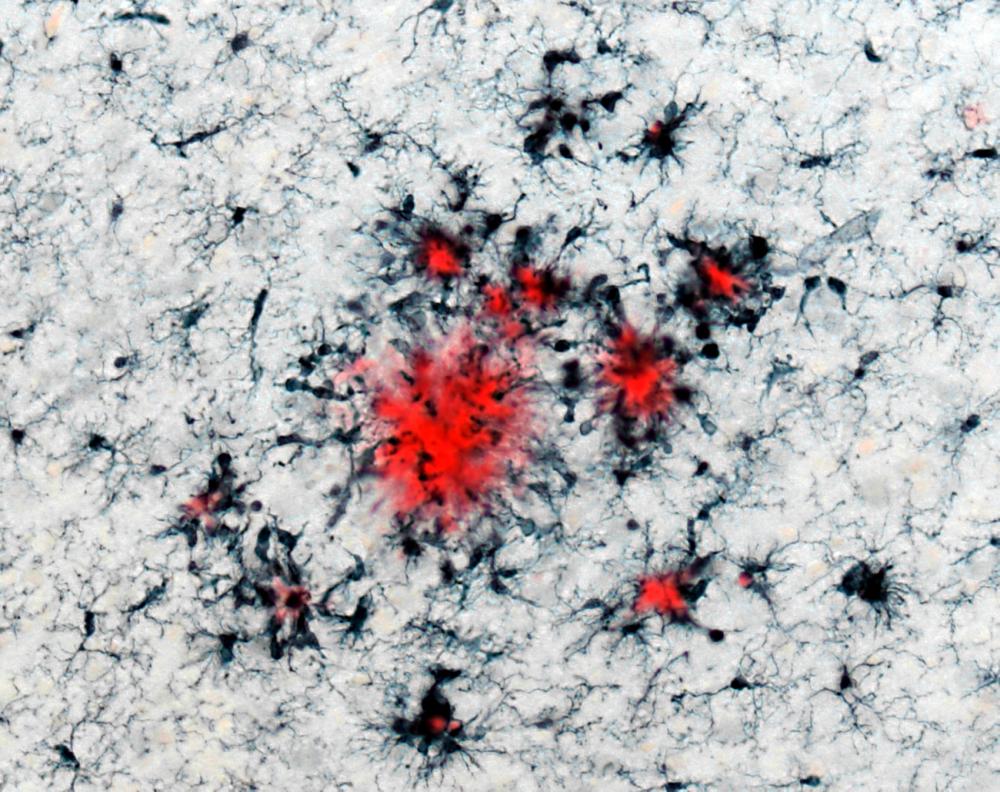
Leiter der aktuellen Studie: Dr. Jonas Neher, Wissenschaftler am Hertie-Institut für klinische Hirnforschung und Deutschen Zentrum für Neurodegenerative Erkrankungen. Copyright: HIH/Akshay Markanday | Tübinger Forscher haben festgestellt, dass die Immunzellen des Gehirns sich an vorherige Entzündungen „erinnern“ können. Sie berichten darüber im Fachjournal „Nature“. Diese Abbildung zeigt solche Immunzellen (in Schwarz), die sich rund um sogenannte Plaques (in Rot) versammelt haben. „Plaques“ sind unlösliche Proteinablagerungen und typisch für die Alzheimer-Erkrankung. Copyright: DZNE & HIH/Neher |