attempto online
08.12.2021
Die „Innere Uhr“ regulieren
Neu identifiziertes Sensorprotein beeinflusst Stoffwechsel in Cyanobakterien und Tag-Nacht-Rhythmus
Auch Cyanobakterien haben einen Tag-Nacht-Rhythmus: Der Stoffwechsel dieser ältesten Lebensformen der Erde passt sich dem Wechsel von Tag und Nacht an, einem sogenannten zirkadianen Rhythmus. Forschende der Universität Tübingen und des Max-Planck-Instituts für Entwicklungsbiologie sowie der Universitäten Göttingen, Rostock und Hannover haben nun erstmals entschlüsselt, welches Protein diese Anpassung reguliert. Versteht man die molekularen Grundlagen von solchen Prozessen, die mit der sogenannten „zirkadianen Uhr“ oszillieren, kann dies helfen, auch die „innere Uhr“ anderer Organismen zu verstehen, einschließlich des Menschen. Diese regelt nicht nur den Tag-Nacht-Rhythmus, sondern auch zahlreiche physiologische Prozesse, einschließlich unseres Stoffwechsels.
Dass Cyanobakterien ihren Stoffwechsel beim Übergang von Tag zu Nacht mit Hilfe der zirkadianen Uhr anpassen, war bereits bekannt. Während des Tages betreiben sie Photosynthese und speichern Kohlenstoffquellen in Form von Glykogen. Während der Nacht wird das Glykogen zur Energiegewinnung abgebaut, so dass die Cyanobakterien nächtliche Dunkelheitsperioden überleben können.
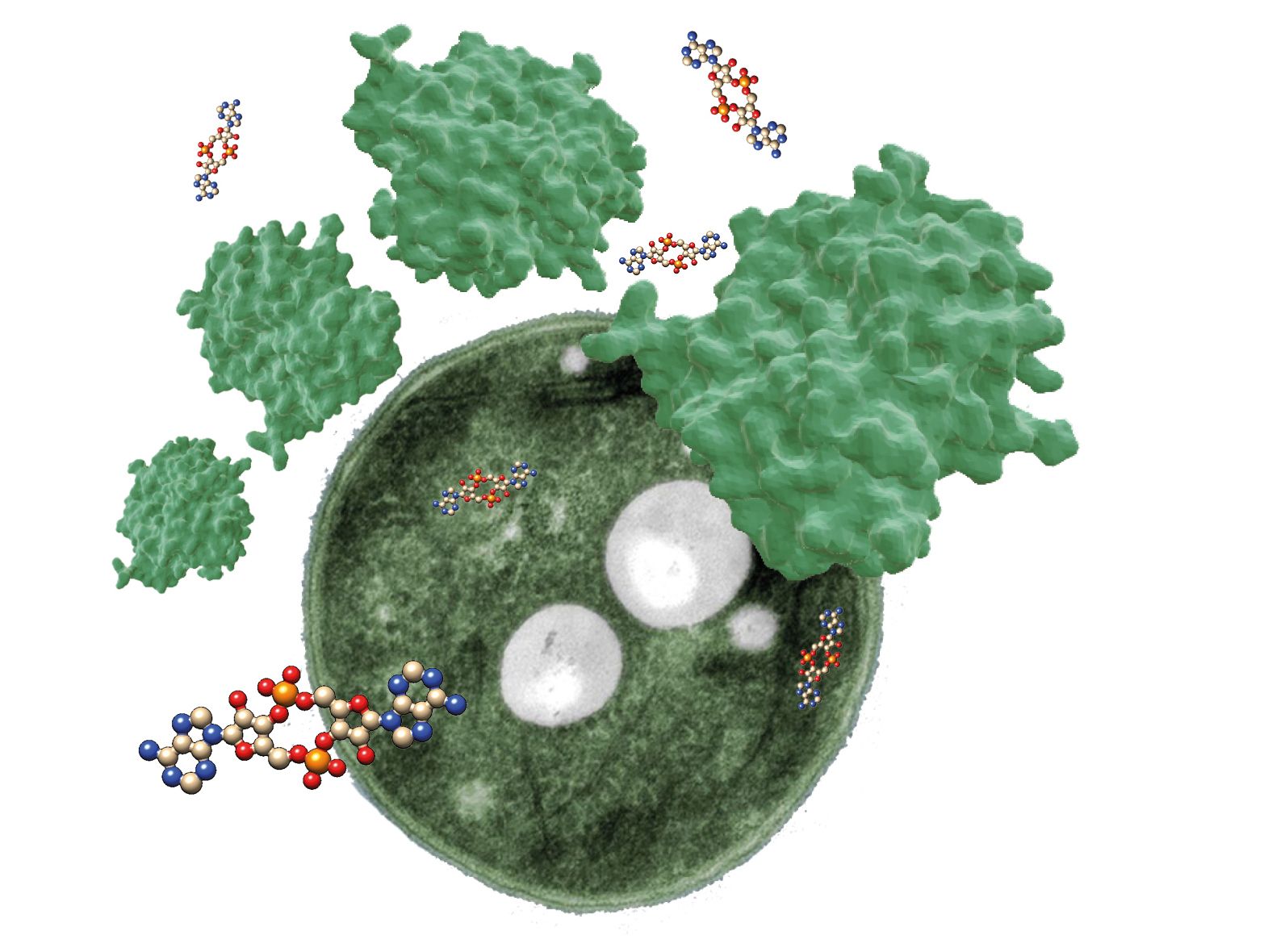
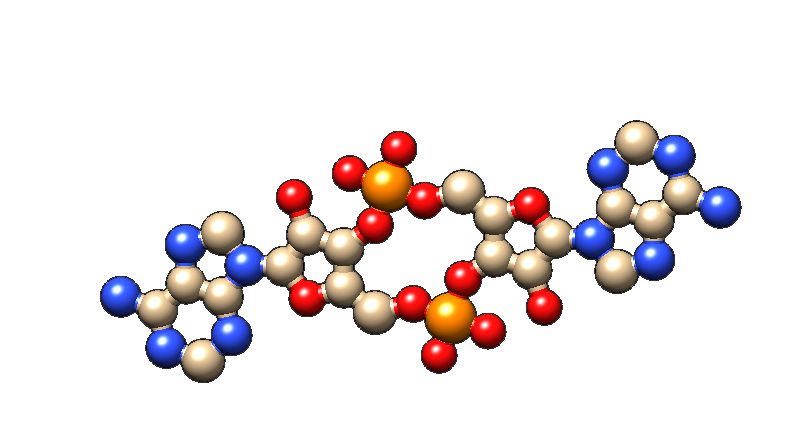
Dr. Khaled Selim und Professor Karl Forchhammer vom Interfakultären Institut für Mikrobiologie und Infektionsmedizin (IMIT) und dem Max-Planck-Institut für Entwicklungsbiologie und Projektgruppenleiter im Exzellenzcluster „Controlling Microbes to Fight Infections“ (CMFI) der Universität haben nun mit Kollegen zwei Verantwortliche für diesen Prozess identifiziert: Das Protein SbtB, das an der Regulierung der CO2-Aufnahme - ein für die Photosynthese wichtiger Prozess - beteiligt ist sowie den chemischen Botenstoff c-di-AMP. Das Botenmolekül c-di-AMP wird von fast allen lebenden Bakterien synthetisiert und dient dazu, die Bakterien über ihren internen und/oder externen aktuellen Zellstatus zu informieren. c-di-AMP leitet sich von dem bekannten Nukleotid Adenosintriphosphat (ATP) ab, welches der Grundbaustein der RNA ist. Die Forschenden um Dr. Selim und Prof. Forchhammer zeigten, dass der chemische Botenstoff c-di-AMP an der Reaktion von Bakterienzellen auf osmotischen Stress beteiligt ist und er somit auch auf den Tag-Nacht-Rhythmus über die Regulierung des Glykogenstoffwechsels einwirkt.
Es war bereits bekannt, dass SbtB die Kohlenstoffaufnahme regulieren kann. Dr. Selim und Kollegen haben nun gezeigt, dass es auch den Glykogenstoffwechsel reguliert, was auf eine umfassendere Rolle bei der Regulierung des zentralen Kohlenstoffstoffwechsels hindeutet. Wenn SbtB an das Nukleotid c-di-AMP gebunden ist, interagiert es mit einem wichtigen Enzym für die Glykogensynthese. Interessanterweise erreicht die Konzentration sowohl von c-di-AMP als auch von SbtB tagsüber ihren Höhepunkt und nachts ihr Minimum. Ohne die beiden Substanzen wären die Zellen nicht in der Lage, die Nacht zu überleben, da sie tagsüber nicht genügend Glykogenspeicher aufbauen können, so die Forscher. Dies deutet darauf hin, dass c-di-AMP und SbtB den Glykogenstoffwechsel im Rahmen des natürlichen Tag-Nacht-Rhythmus regulieren.
Die Forschenden gehen davon aus, dass das Verständnis der molekularen Mechanismen hinter diesem zentralen Regulator SbtB dazu dienen kann, den Kohlenstoffluss in Cyanobakterien zu manipulieren. Dies könnte die Herstellung nützlicher Produkte, wie beispielsweise des biologisch abbaubaren Kunststoffs PHB oder andere chemische Ausgangsstoffe effizienter und in industriellem Maßstab anwendbar machen.
Im größeren Kontext verbessern die Erkenntnisse nicht nur unser Verständnis der Verstoffwechselung von Kohlenstoff bei Cyanobakterien, sondern auch insgesamt der molekularen Grundlagen von Prozessen, die mit der zirkadianen Uhr wechselwirken. Dies hilft wiederum, den Tag-Nacht-Rhythmus anderer Organismen - inklusive des Menschen - zu erklären. „Eines Tages können wir dadurch vielleicht besser verstehen, warum uns beispielsweise Essen am Tag und Fasten in der Nacht vor Krankheiten wie Fettleibigkeit und Diabetes schützt“, erklärt Khaled Selim.
Publikation:
Selim KA, Haffner M, Burkhardt M, Mantovani O, Neumann N, Albrecht R, Seifert R, Krüger L, Stülke J, Hartmann MD, Hagemann M, Forchhammer K: Diurnal metabolic control in cyanobacteria requires perception of second messenger signaling molecule c-di-AMP by the carbon control protein SbtB. Science Advances 7: eabk0568. (2021) doi: 10.1126/sciadv.abk0568.
Kontakt:
Dr. Khaled Selim
Universität Tübingen
Interfakultäres Institut für Mikrobiologie und Infektionsmedizin (IMIT) | Exzellenzcluster „Controlling Microbes to Fight Infections“ (CMFI)
+49 7071 29 74634
khaled.selimspam prevention@uni-tuebingen.de
Pressekontakt
Leon Kokkoliadis
Medien- und Öffentlichkeitsarbeit
+49 7071 29-74707
leon.kokkoliadisspam prevention@uni-tuebingen.de