Pressemitteilungen
17.11.2022
Neuer Ansatzpunkt für Alzheimer-Therapien gefunden
Forschende des DZNE entdecken Zusammenhang zwischen dem Protein Medin und der Alzheimer-Erkrankung
In den Blutgefäßen des Gehirns von Alzheimer-Patienten lagert sich zusammen mit dem Protein Amyloid-β auch das Protein Medin ab. Diese sogenannte Co-Aggregation haben Forschende am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) entdeckt. Ihre Beobachtung veröffentlichen sie jetzt im renommierten Fachmagazin Nature. „Medin ist zwar schon seit rund 20 Jahren bekannt, wurde aber in seinem Einfluss auf Krankheiten bisher unterschätzt. Wir konnten zeigen, dass krankhafte Veränderungen der Blutgefäße von Alzheimer-Patienten durch Medin deutlich verstärkt werden“, sagt Studienleiter Dr. Jonas Neher vom Tübinger Standort des DZNE. An der langjährigen Studie waren außerdem das Hertie-Institut für klinische Hirnforschung in Tübingen, die Universität Tübingen und mehrere internationale Institutionen und Kooperationspartner beteiligt.
Medin gehört zur Gruppe der Amyloide. Von diesen Proteinen ist Amyloid-β am besten bekannt, da es im Gehirn von Alzheimer-Patienten verklumpt. Diese Aggregate lagern sich dann sowohl als sogenannte Plaques direkt im Gehirngewebe, aber auch in dessen Blutgefäßen ab und schaden dadurch den Nervenzellen bzw. den Blutgefäßen. Während sich daher viele Studien mit Amyloid-β beschäftigten, stand Medin bisher nicht im Mittelpunkt des Interesses. „Es gab wenig Hinweise auf eine Pathologie, also auf einen klinisch auffälligen Befund in Zusammenhang mit Medin – und das ist oft die Voraussetzung für eine eingehendere Beschäftigung mit einem Amyloid“, erklärt Jonas Neher.
Tatsächlich findet sich Medin jedoch in den Blutgefäßen von fast jedem Menschen über 50 Jahren und ist somit das häufigste bekannte Amyloid. Mit seinem Team stellte Jonas Neher ursprünglich fest, dass Medin sich sogar in alternden Mäusen entwickelt, und berichtete vor zwei Jahren im Wissenschaftsjournal PNAS über diese Entdeckung. Auch in den Blutgefäßen des Gehirns von Mäusen sammelt sich umso mehr Medin an, je älter sie werden - das war damals der Befund. Und: Wenn das Gehirn aktiv wird und mehr Blutzufuhr benötigt, dehnen sich Gefäße mit Medin-Ablagerungen langsamer aus als solche ohne Medin. Diese Fähigkeit der Ausdehnung jedoch ist wichtig, um das Gehirn optimal mit Sauerstoff und Nährstoffen zu versorgen.
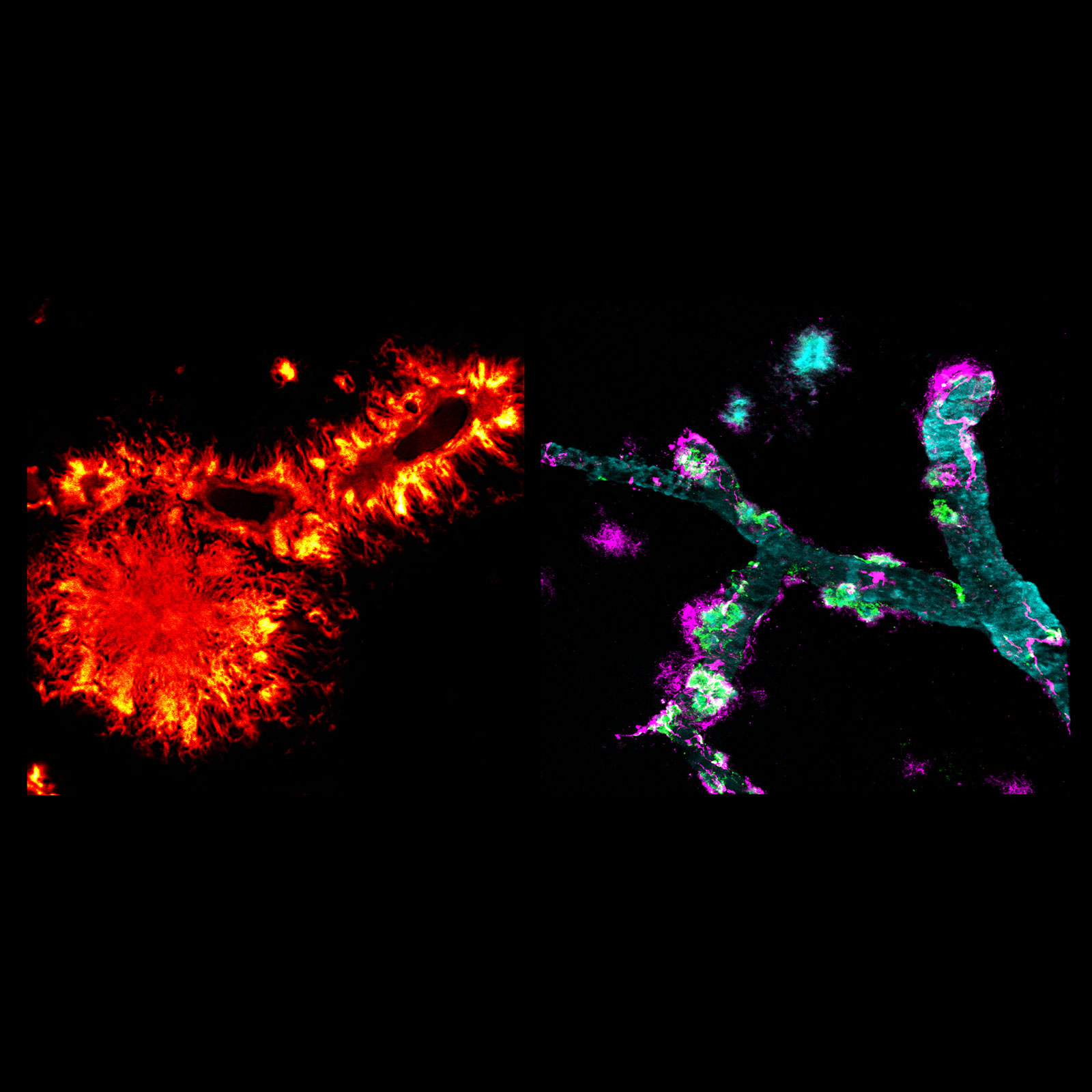
Für ihre jüngsten Ergebnisse bauten die Forschenden auf dieser Grundlage auf und blickten gezielt auf die Alzheimer-Erkrankung. Sie konnten dabei zuerst an Alzheimer-Mausmodellen zeigen, dass sich Medin noch stärker in Blutgefäßen des Gehirns anreichert, wenn dort auch Amyloid-β Ablagerungen vorhanden sind. Entsprechende Befunde konnten dann auch in Hirngewebe von Organspendern mit Alzheimer-Demenz nachgewiesen werden. Wurden jedoch Mäuse genetisch so verändert, dass Medin nicht gebildet werden kann, kam es zu deutlich weniger Amyloid-β-Ablagerungen und dadurch auch zu signifikant weniger Schaden an den Blutgefäßen.
„Es gibt weltweit nur eine Handvoll Arbeitsgruppen, die überhaupt zu Medin arbeiten“, sagt Jonas Neher. Eine vorherige Studie aus den USA beschrieb zwar kürzlich, dass der Medinspiegel bei Alzheimer-Patienten steigt. Dabei blieb aber ungeklärt, ob dies lediglich die Folge der Erkrankung ist oder ob es hingegen zu den Ursachen gehört. „Wir konnten jetzt über viele Versuche zeigen, dass Medin die vaskuläre Pathologie in Alzheimermodellen fördert“, so Neher. Die Medin-Ablagerungen sind also tatsächlich eine Ursache für die Schädigung von Blutgefäßen. „Und das ist ein Indiz dafür, dass es die Krankheit mitverursacht“, so Neher.
In ihren Studien färbten die Forschenden dabei Gewebeschnitte sowohl von Mäusen als auch von Alzheimer-Patienten so, dass konkrete Proteine sichtbar werden. Dadurch konnten sie zeigen, dass sich Medin und Amyloid-β gemeinsam in Blutgefäßen des Gehirns ablagern – Co-Lokalisation ist dafür der Fachbegriff. Mit weiteren Versuchen konnten sie in einem nächsten Schritt beweisen, dass diese beiden Amyloide auch co-aggregieren – also gemischte Anhäufungen bilden. „Erstaunlicherweise interagiert Medin direkt mit Amyloid-β und fördert dessen Aggregation – das war noch vollkommen unbekannt“, fasst Jonas Neher die Ergebnisse zusammen.
Genau daraus schöpfen die Forschenden Hoffnung für die Entwicklung einer möglichen Behandlung. „Medin könnte ein therapeutisches Ziel sein, um vaskuläre Schäden und kognitive Verschlechterungen zu verhindern, die aus Amyloid-Ansammlungen in den Blutgefäßen des Gehirns resultieren“, lautet ihre Schlussfolgerung. In Fachkreisen ist es unumstritten, dass Ursachen für die Alzheimer Erkrankung nicht nur die Aggregate von Amyloid-β im Hirngewebe, sondern auch vaskuläre Veränderungen sind – also die verringerte Funktion oder die Beschädigung von Blutgefäßen. Nimmt man bei einer Behandlung also nicht nur die Plaques als Angriffspunkt, sondern auch die betroffenen Blutgefäße, könnte das den Patientinnen und Patienten helfen.
In einem nächsten Schritt muss jetzt geklärt werden, ob sich bereits gebildete Medin-Aggregate therapeutisch entfernen lassen und ob dieser Eingriff tatsächlich einen Einfluss auf die Gedächtnisleistung hat. Die Wissenschaftlerinnen und Wissenschaftler wollen das zunächst an Mausmodellen erproben, weil diese die krankhaften Veränderungen in Alzheimer-Patienten sehr gut widerspiegeln.
Originalpublikation:
Medin co-aggregates with vascular Ab in mouse models and Alzheimer patients
Jessica Wagner, Karoline Degenhardt, Marleen Veit, Nikolaos Louros, Katerina Konstantoulea, Angelos Skodras, Katleen Wild, Ping Liu, Ulrike Obermüller, Vikas Bansal, Anupriya Dalmia, Lisa M. Häsler, Marius Lambert, Matthias De Vleeschouwer, Hannah A.Davies, Jillian Madine, Deborah Kronenberg-Versteeg, Regina Feederle, Domenico Del Turco, K. Peter R. Nilsson, Tammaryn Lashley, Thomas Deller, Marla Gearing, Lary C. Walker, Peter Heutink, Frederic Rousseau, Joost Schymkowitz, Mathias Jucker, Jonas J. Neher
https://www.nature.com/articles/s41586-022-05440-3
Kontakt
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
Sabine Hoffmann
Communications
Head and Press Spokesperson
+ 49 228 43302-260
sabine.hoffmann@dzne.de
www.dzne.de
Hertie-Institut für klinische Hirnforschung
Dr. Mareike Kardinal
Leiterin Kommunikation
+49 7071 29-88800
mareike.kardinal@medizin.uni-tuebingen.de
www.hih-tuebingen.de
Eberhard Karls Universität Tübingen
Hochschulkommunikation
Dr. Karl Guido Rijkhoek
Leitung
Antje Karbe
Pressereferentin
Telefon +49 7071 29-76789
antje.karbe@uni-tuebingen.de
Alle Pressemitteilungen der Universität Tübingen